光腫瘍免疫
抗体ミメティクスによる進行がん治療
抗体ミメティクスによる進行がん治療

東京大学の先端の研究施設で、再発と転移を伴う進行がんに対し、軽い負担で高い有効率、そして根治を目指す薬の開発を進めています。ゲノム科学から標的の探索を進め(東大医学部との共同)、抗体ミメティクスを作成し(東大アイソトープセンターとの共同)、新規の光活性化の抗がん剤Ax-SiPcとの抗体ミメティクス結合薬(東大薬学部、大阪大学との共同)、デュオカルマイシンやヤタケマイシンとの抗体ミメティクス結合薬(東北大薬学部との共同)を開発しています。さらに、mRNA医薬品での腫瘍免疫活性化、イントラボディーでの細胞内抗がん剤の開発(医科歯科大学との共同)を進めています。
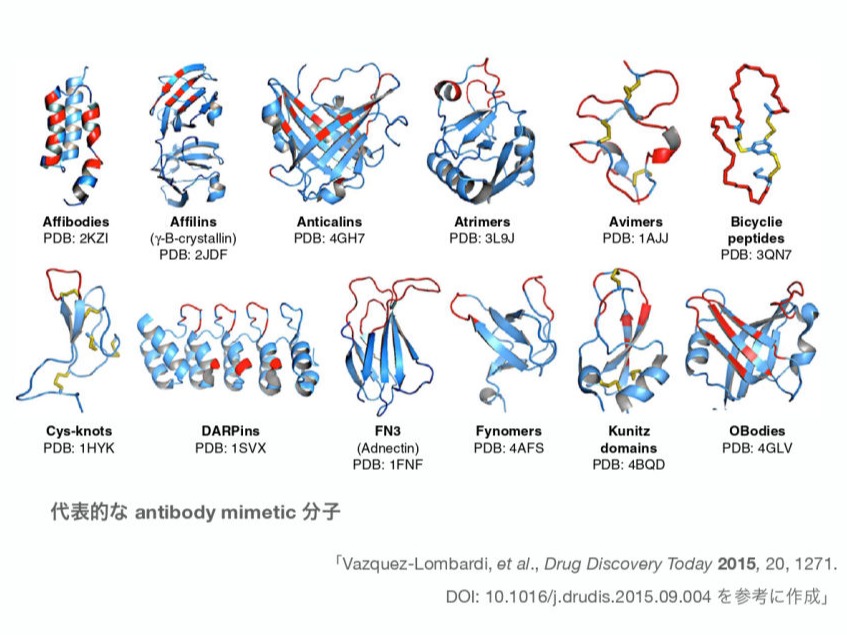
Antibody mimetic(抗体模倣物質)は、抗体と同様に抗原に特異的に結合することができ、分子量が約 3~20 kDa のタンパク質です。しかし、構造的には抗体と関連性がありません。核酸や低分子化合物も抗体模倣物質とみなされることがあります。抗体と比較した場合の利点は、溶解性、組織への浸透性、熱や酵素に対する安定性、比較的低い生産コストなどがあげられます。近年 antibody mimetic を利用した、治療薬や診断薬の開発が進められています。現在、約18種類の antibody mimetic が報告されており、それらの中で抗体模倣品の典型的な例としては、Affibody、Affilins、Affirmers、Anticlins などがあげられます。
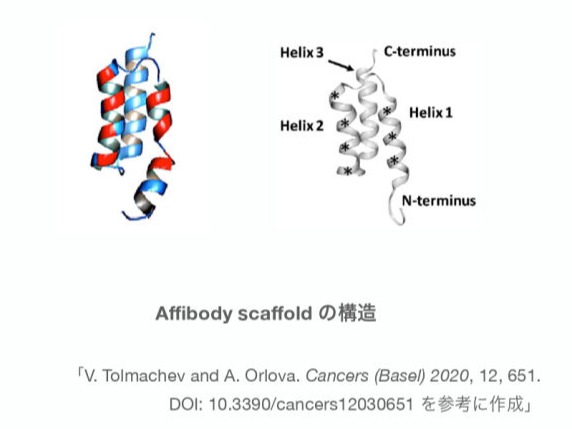
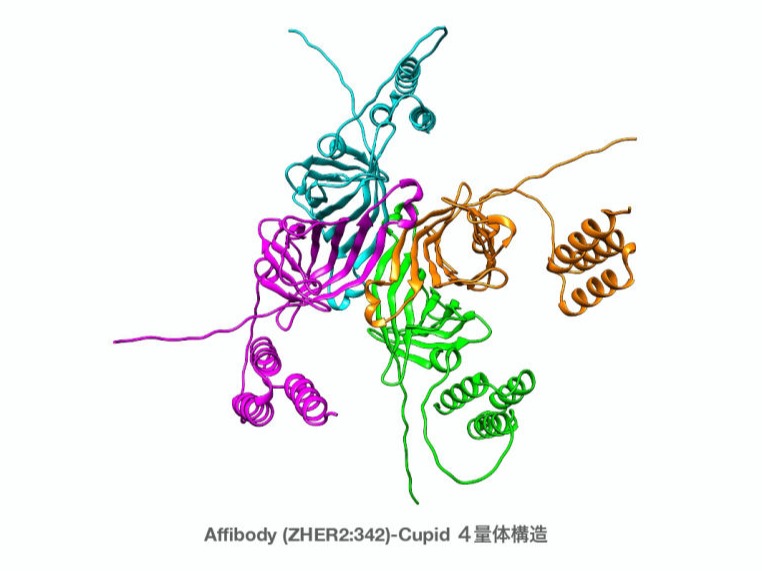
Affibody(アフィボディ)分子は、モノクローナル抗体を模倣し、多数の標的タンパク質またはペプチドに高い親和性で結合するように人工設計された antibody mimetic の1つです。アフィボディは 58アミノ酸(6 kDa)と小さく、温度(90˚C)やpH(2.5~11)などに対し高い安定性をもっています。アフィボディ分子は3ヘリックスバンドルドメインで構成されており、融合体タンパク質としても可溶性で安定した形で発現できます。アフィボディ自身は、システインまたはジスルフィド結合を含まないため、微生物での製造も容易です。標的特異的なアフィボディはファージディスプレイ法などのディスプレイ法でスクリーニングされます。さらに親和性成熟(アフィニティマチュレーション)によりピコモルの親和性をもつバインダーも製造可能です。われわれはaffibodyを使用した新しい薬剤AMDC (antibody mimetic drug conjugate) の開発に成功しています。
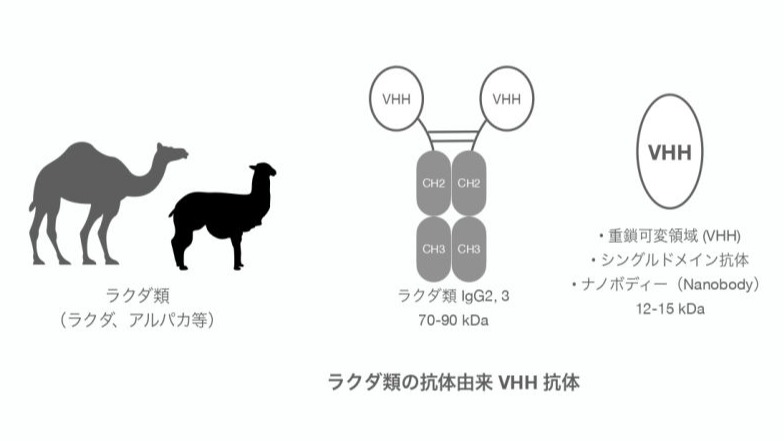
ラクダ科動物のラマやアルパカなどが有する抗体はH鎖のみで構成されており、その可変領域はVHH( variable domain of heavy chain of heavy chain antibody)抗体、シングルドメイン抗体(sdAb)やナノボディー(nanobody)とも呼ばれています。VHH抗体は温度やpHなどに対し高い安定性をもっています。一般的なIgGから軽鎖と重鎖の可変領域をリンカーで繋いだ、一本差抗体(scFv; single chain varible fragment) は、分子量25 kDaであり、構造が複雑ですが、VHHは分子量15 kDaで簡単な構造をしています。このため、微生物での低コスト生産も可能で、融合タンパクの製造など、タンパク質工学的な改変も容易です。
AMDCは antibody mimetic drug conjugate を意味し、antibody mimetic を使用した薬剤送達システムをさします。わたしたちは antibody mimetic の1つである affibody と、わたしたちが開発したストレプトアビジン改変体 (Cupid) タンパクの融合体を作製しました。その融合体は、ビオチンの改変体(Psyche)を溶液中で混ぜるだけで Cupid 分子に非共有結合で結合させることが可能です。Psycheにはペイロードとして、治療や診断を行うための薬剤を、リンカーを介し結合可能です。がん細胞などの細胞表面タンパク質を標的とし認識する antibody mimetic によりPsycheに結合した薬剤を目的の細胞へ送達することが可能です。今までに、放射性核種を用いたPETイメージング、光増感剤を用いた腫瘍の消失に成功しています。
Yamatsugu et al. Protein Expr. Purif. 2022, 192, 106043. DOI: 10.1016/j.pep.2021.106043
Sugiyama et al. Proc Jpn Acad Ser B Phys Biol Sci. 2019, 95, 602. DOI: 10.2183/pjab.95.041
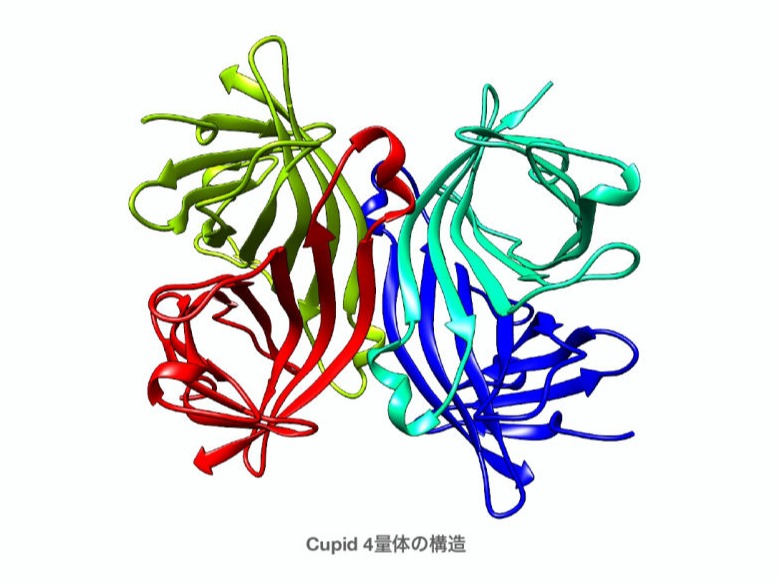
わたしたちが開発した、ストレプトアビジン改変体で低免疫原性、人体内にビタミンとして存在するビオチンとは結合しないように改変したタンパク質になります。ヒトのプロテオーム配列をもとに放線菌由来のストレプトアビジンを人体内で使用できるように免疫原性を低く抑えることに成功しました。また、ビオチン結合ポケットを改変することで人体内のビオチンとは結合せずにビオチンを改変したPsyche分子と高い親和性での結合を実現しています。
Yumura et al. Protein Sci. 2013, 22, 213. DOI: 10.1002/pro.2203
Kawato et al. J Biochem. 2015, 157, 467. DOI: 10.1093/jb/mvv004
Kawato et al. J Biosci Bioeng 2015, 119 , 642. DOI: 10.1016/j.jbiosc.2014.10.025
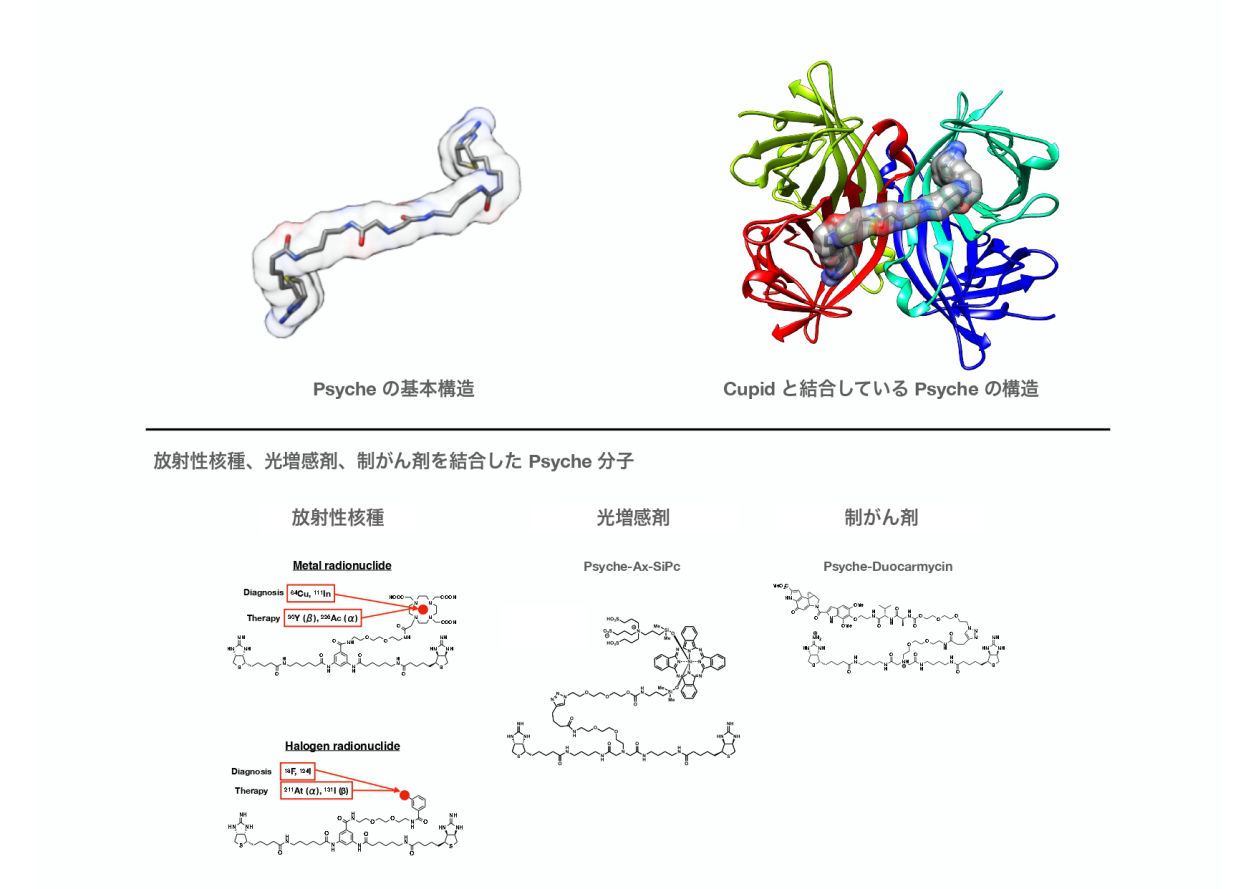
人体内にビタミンとして存在するビオチンとは結合しないように改変したタンパク質がCupidでした。今度はそのCupidに人体内で選択的に結合するよう、ビオチン側を改変して生まれたのがPsycheです。ビオチンに含まれる酸素原子のひとつを窒素原子に置き換え、それをさらに2量化することで、Cupidへの高い親和性を実現しています。Psycheには、制がん剤や、光増感剤、放射性核種に至るまで、さまざまなペイロードを結合させることが可能であり、Cupidと組み合わせて用いることで、人体内の狙ったがん組織へと薬物を選択的に届けることが可能です。Psycheは化学的に原子レベルで改変が可能な低分子であり、目的に応じた様々なチューニングが可能になっています。
Kawato et al. Biosci Biotechnol Biochem. 2015, 79, 640. DOI: 10.1080/09168451.2014.991692
わたしたちが開発した、近赤外光を吸収して細胞傷害性の高い一重項酸素を発生させる光増感剤です。近赤外光は組織透過性の比較的高い光とされており、人体の外から照射することで、体表面あるいは表層に近い体内部に光エネルギーを届けることが可能です。わたしたちは、PsycheにAx-SiPcを化学的に結合し、目的のがん組織を狙ったCupidと組み合わせて用いることで、Ax-SiPcを動物体内でがん組織へと選択的に送達することに成功しました。そしてさらに、体外から近赤外光を照射することで、がんに集積したAx-SiPcを活性化し、一重項酸素を発生させることで、がんを完全に消失させることに成功しています。
Yamatsugu et al. Protein Expr. Purif. 2022, 192, 106043.
Kaneko et al. Cancer Sci. 2022, 113, 4350. DOI: 10.1111/cas.15565
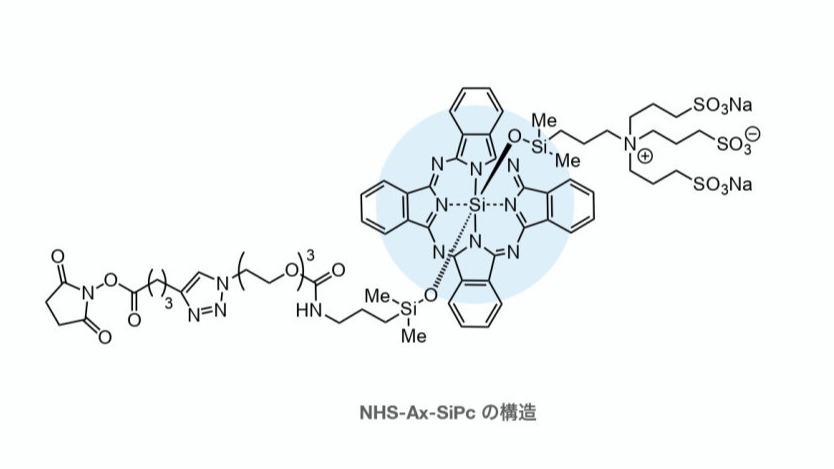
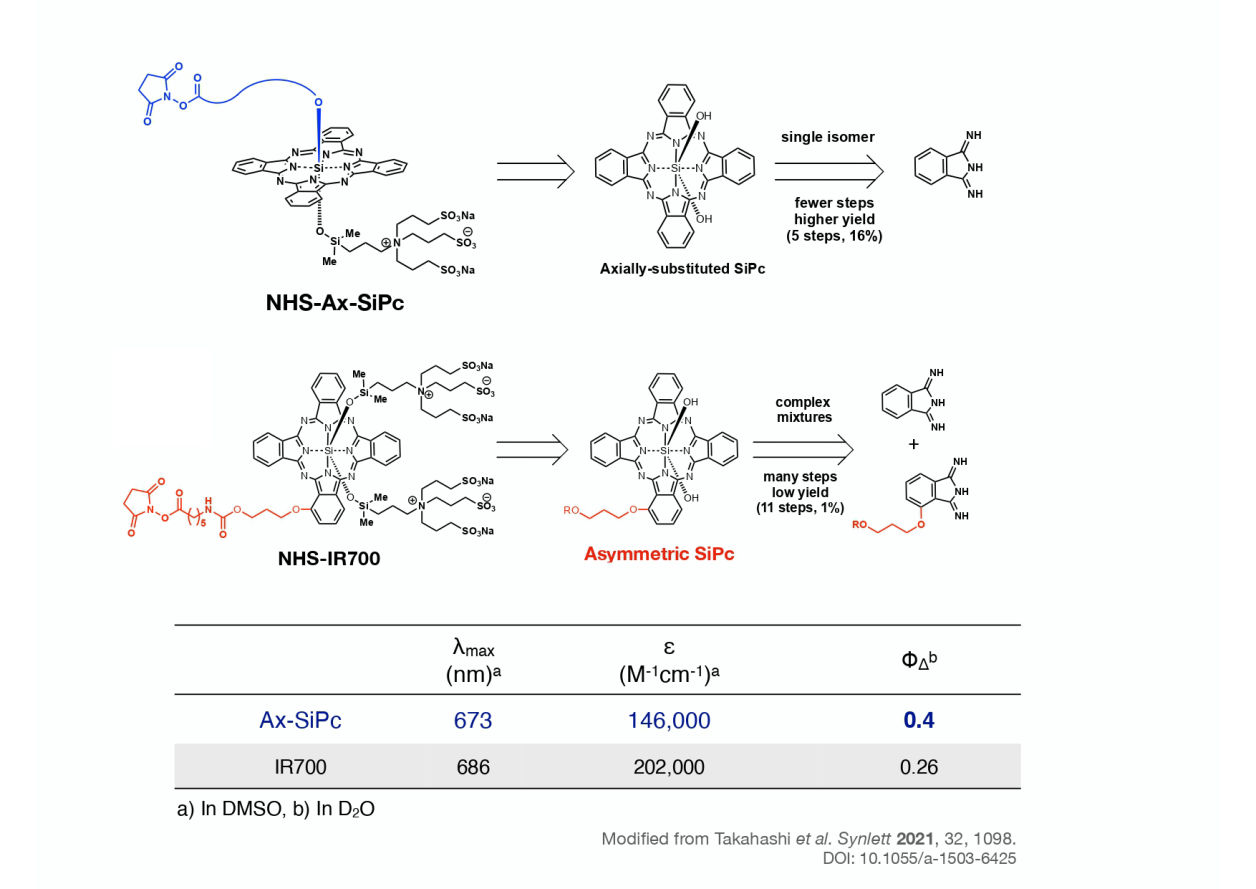
近赤外光の照射によってがんを縮退させるアプローチはAx-SiPcが初めてではありません。現在、アキャルックスという名前で販売されている抗体薬物複合体には、IR700と呼ばれる光増感剤が使われています。IR700は非常に有効な光増感剤ですが、その構造の複雑さのため、製造の効率が高くなく、また医薬効果をさらに改善するための構造改変が困難です。わたしたちは、IR700の構造を大幅に単純化することで、その機能の大半を維持しながら、半分以下の合成工程数、10倍以上の収量で製造可能な光増感剤を開発しました。それがAx-SiPcです。さらに、Ax-SiPcはIR700よりも一重項酸素の発生効率が高いというデータも出ており、より有効な光増感剤としての使用が期待されます。
Takahashi et al. Synlett 2021, 32, 1098.
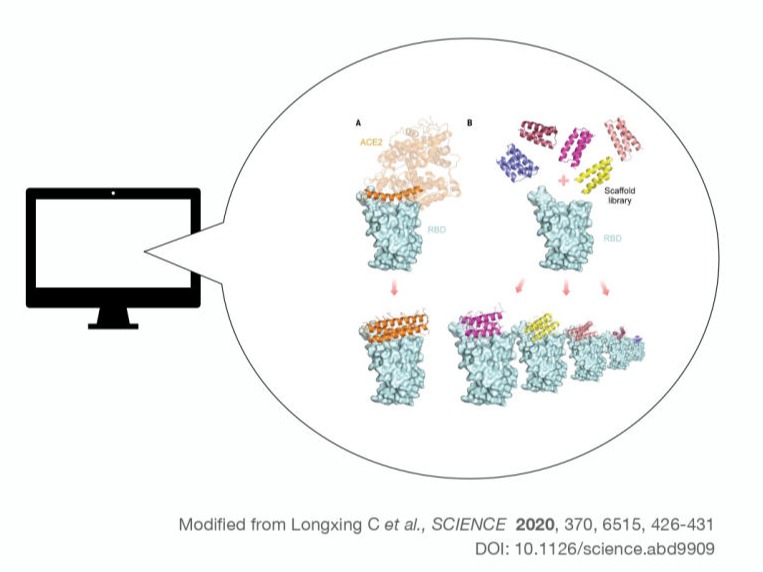
計算機の演算性能の向上・タンパク質間相互作用の分子論的理解の発展により、標的タンパク質に強力に結合する小さなタンパク質(~100アミノ酸以下)を計算設計できることが実証されつつあります。この結合能を持つ人工タンパク質はCupidと容易に融合させることができ、抗体ミメティクス-薬剤共役(AMDC)のモジュールとして利用できます。標的タンパク質が同定されれば、計算による合理的設計により迅速にAMDCを開発することが可能となります。
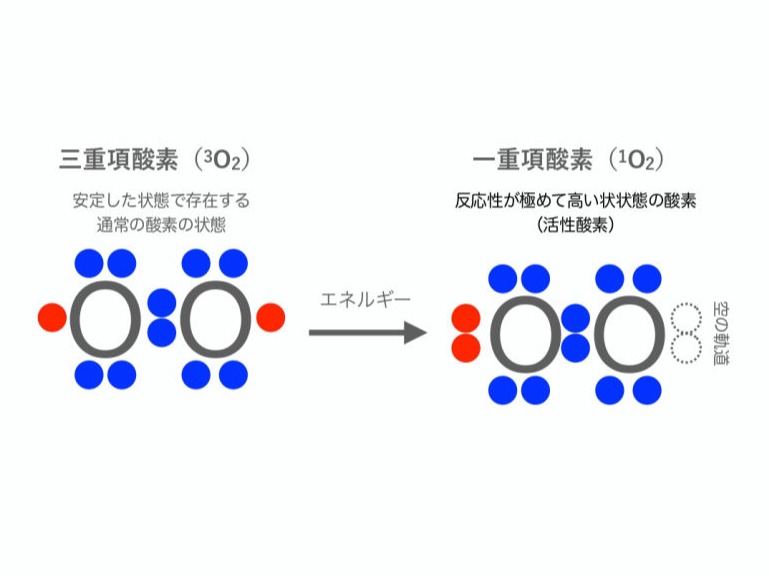
一重項酸素は、空気に含まれている酸素分子の励起状態で、反応性が極めて高く蛋白質や遺伝子など様々な生体物質を酸化することができます。その生成方法は、色素分子に紫外線や可視光などを吸収させる、光増感法が一般的です。特にAx-SiPcやIR700などのπ系色素分子は、光エネルギーを吸収することよって生成する3重項励起状態の寿命が長く、酸素へエネルギーを効率良く渡すことができることから、一重項酸素の生成効率(量子収率)が非常に高いことが知られています。一重項酸素は、色素分子が集積している部分あるいは光照射した部分に選択的に生成させることができるので、がん治療などに用いられています。